Адамның EGFR генінің 29 мутациялары
Өнім атауы
HWTS-TM001A-Human EGFR Gene 29 мутацияларды анықтау жинағы (флуоресцентті ПТР)
Эпидемиология
Өкпенің қатерлі ісігі бүкіл әлемде онкологиялық аурулардан болатын өлім-жітімнің басты себебі болды, бұл адам денсаулығына елеулі қауіп төндіреді.Өкпенің ұсақ жасушалы емес қатерлі ісігі өкпе қатерлі ісігімен ауыратын науқастардың шамамен 80% құрайды.EGFR қазіргі уақытта өкпенің ұсақ жасушалы емес қатерлі ісігін емдеудегі ең маңызды молекулалық мақсат болып табылады.EGFR фосфорлануы ісік жасушаларының өсуіне, дифференциациясына, инвазияға, метастазға, апоптозға қарсы тұруға және ісік ангиогенезіне ықпал ете алады.EGFR тирозинкиназа тежегіштері (TKI) EGFR автофосфорлануын тежеу арқылы EGFR сигнал беру жолын блоктай алады, осылайша ісік жасушаларының пролиферациясын және дифференциациясын тежейді, ісік жасушаларының апоптозын ынталандырады, ісік ангиогенезін төмендетеді және т.б., ісікке бағытталған терапияға қол жеткізу.Көптеген зерттеулер EGFR-TKI терапевтік тиімділігі EGFR генінің мутациясының күйімен тығыз байланысты екенін және EGFR генінің мутациясы бар ісік жасушаларының өсуін арнайы тежей алатынын көрсетті.EGFR гені 7-хромосоманың қысқа иінінде (7p12) орналасқан, толық ұзындығы 200Кб және 28 экзоннан тұрады.Мутацияланған аймақ негізінен 18-ден 21-ге дейінгі экзондарда орналасқан, 19-экзондағы 746-753 кодондардағы делециялық мутация шамамен 45% құрайды және 21-экзондағы L858R мутациясы шамамен 40% - 45% құрайды.Ұсақ жасушалы емес өкпе обырын диагностикалау және емдеу жөніндегі NCCN нұсқаулығында EGFR-TKI енгізу алдында EGFR генінің мутациясына тестілеу қажет екені анық айтылған.Бұл сынақ жинағы эпидермиялық өсу факторы рецепторларының тирозинкиназа ингибиторы (EGFR-TKI) препараттарын енгізуді бағыттау үшін пайдаланылады және өкпенің ұсақ жасушалы емес қатерлі ісігі бар емделушілер үшін жекелендірілген медицинаға негіз береді.Бұл жинақ өкпенің ұсақ жасушалы емес қатерлі ісігі бар емделушілерде EGFR геніндегі жалпы мутацияларды анықтау үшін ғана қолданылады.Сынақ нәтижелері тек клиникалық анықтамаға арналған және пациенттерді жеке емдеу үшін жалғыз негіз ретінде пайдаланылмауы керек.Клиниктер пациенттің жағдайын, дәрілік көрсеткіштерді және емдеуді ескеруі керек. Сынақ нәтижелерін жан-жақты бағалау үшін реакция және басқа зертханалық сынақ көрсеткіштері және басқа факторлар пайдаланылады.
Арна
| FAM | IC реакция буфері, L858R реакция буфері, 19del реакция буфері, T790M реакция буфері, G719X реакция буфері, 3Ins20 реакция буфері, L861Q реакция буфері, S768I реакция буфері |
Техникалық параметрлер
| Сақтау | Сұйықтық: ≤-18℃ Қараңғыда;Лиофильденген: ≤30℃ Қараңғыда |
| Жарамдылық мерзімі | Сұйықтық: 9 ай;Лиофильденген: 12 ай |
| Үлгі түрі | жаңадан ісік ұлпасы, мұздатылған патологиялық кесінді, парафинмен қондырылған патологиялық тін немесе кесінді, плазма немесе сарысу |
| CV | <5,0% |
| LoD | нуклеин қышқылы реакциясының ерітіндісін 3 нг/мкл жабайы түр фонында анықтау, 1% мутация жылдамдығын тұрақты анықтай алады |
| Ерекшелік | Жабайы типтегі адам геномдық ДНҚ және басқа мутант түрлерімен айқаспалы реакция жоқ |
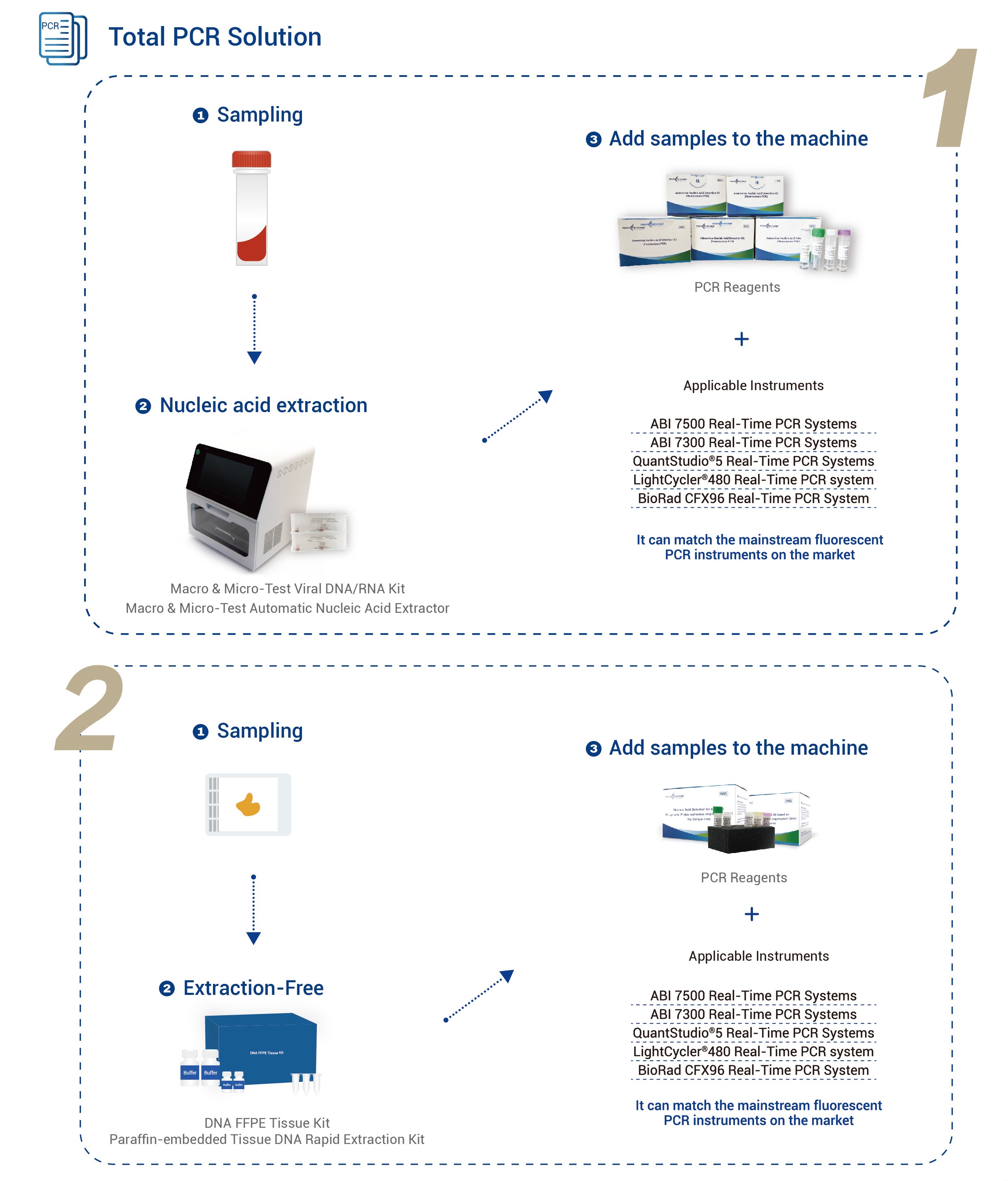
| Қолданылатын құралдар | Қолданбалы Biosystems 7500 нақты уақыттағы ПТР жүйелеріҚолданбалы Biosystems 7300 нақты уақыттағы ПТР жүйелері QuantStudio® 5 нақты уақыттағы ПТР жүйесі LightCycler® 480 нақты уақыттағы ПТР жүйесі BioRad CFX96 нақты уақыттағы ПТР жүйесі |